
Stručné shrnutí
Úvodní informace
Chřipkové viry typu A (IAV) způsobují infekce celosvětového rozsahu, které mají každoročně za následek půl milionu smrtelných případů. V oblastech ležících v mírném klimatickém pásmu dochází k propuknutí těchto chřipkových nákaz v zimních měsících. Svého vrcholu dosahují mezi listopadem a březnem na severní polokouli a mezi květnem a zářím na jižní polokouli. Na těchto epidemiích se podílejí kolísání teploty, nízká vlhkost vzduchu, shromažďování příliš velkého počtu osob ve vnitřních prostorech či nedostatek slunečního světla
a s ním spojený nedostatek vitamínu D.
Výsledek
Z výsledků podrobné studie, jejímiž autory jsou Akiko Iwasaki a kol., opakovaně* vyplývá, že příliš nízká vlhkost vzduchu znatelně zvyšuje náchylnost ke chřipkovým infekcím.
(* Lipsitch a kol. 2010, studie probíhající po dobu 30 roků)
Příliš nízká vlhkost vzduchu v rozsahu 10–20% r. v. má za následek snížení samočisticí schopnosti dýchacích cest, snížení odolnosti proti virům a snížení funkčnosti paměťových buněk imunitního systému. Při vyšší relativní vlhkosti vzduchu (50% r. v.) se tyto snižující účinky nevyskytují.
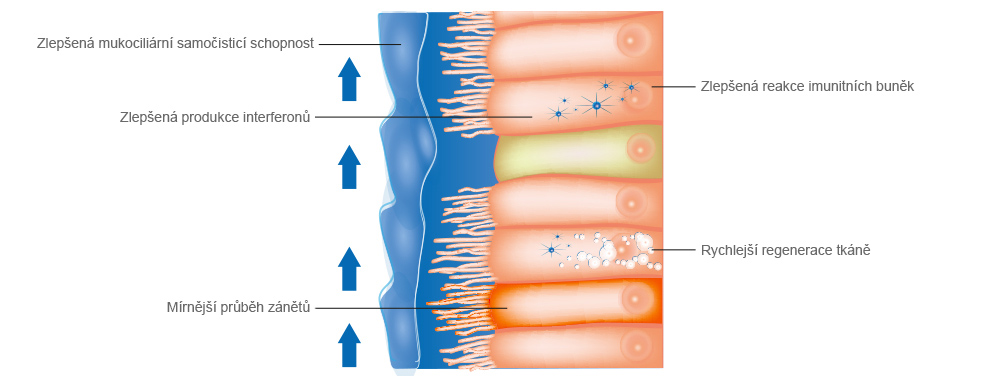
Tři imunitní bariéry zajišťující ochranu před infekcemi
Ochranu před virovou infekcí mají umožňovat 3 bariéry imunitního systému. 1. bariéra sestává ze slizniční vrstvy, kapalinné vrstvy na slizniční vrstvě a řasinky na povrchu. Tyto vrstvy umožňují imunitní obranu proti původcům onemocnění a částicím vnikajícím prostřednictvím dýchacích cest. Jestliže virus pronikne touto první imunitní bariérou, je uvolňován interferon, aby byly aktivovány geny, které dokáží s viry bojovat, případně bránit jejich šíření. Jestliže se viru podaří prorazit také tento vrozený 2. stupeň obrany, aktivuje se jako
3. stupeň adaptivní imunitní systém, který vyvolává specifickou imunitní odezvu na přítomnost viru prostřednictvím paměťových buněk typu B a T.
Tyto tři bariéry se však stávají neúčinnými při pobývání v prostorech s příliš nízkou vlhkostí vzduchu (10–20% r. v.). Následkem toho propuká chřipkové onemocnění. Onemocnění se při nízké relativní vlhkosti vzduchu v rozsahu 10–20 % zvyšuje nezávisle na virovém zatížení. Navíc je zpomalována regenerační schopnost buněčné tkáně.
Při relativní vlhkosti vzduchu dosahující 50 % vykazuje chřipkové onemocnění mírnější průběh s nižší horečkou a kratší dobou trvání.
Studie Dr. Akiko Iwasaki
Co je v našem imunitním systému ovlivňováno právě vlhkostí vzduchu
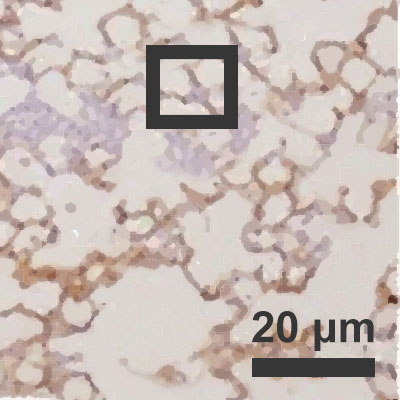 Infikovaný plicní sklípek při
Infikovaný plicní sklípek při vlhkosti vzduchu činící 10 %
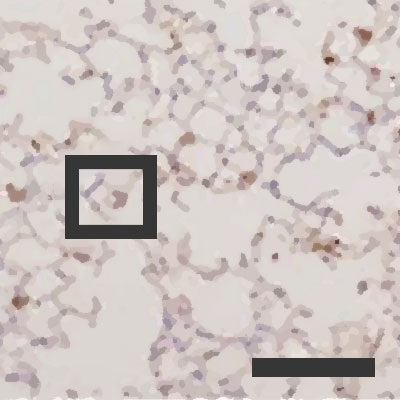 Infikovaný plicní sklípek při
Infikovaný plicní sklípek při vlhkosti vzduchu činící 50 %
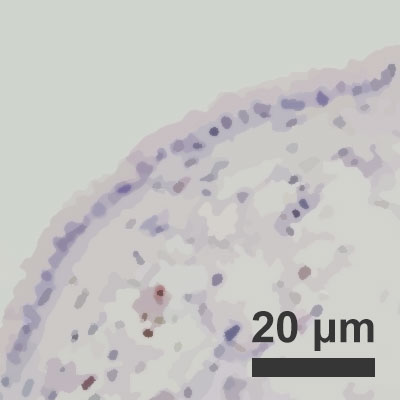 Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 10 %
Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 10 %
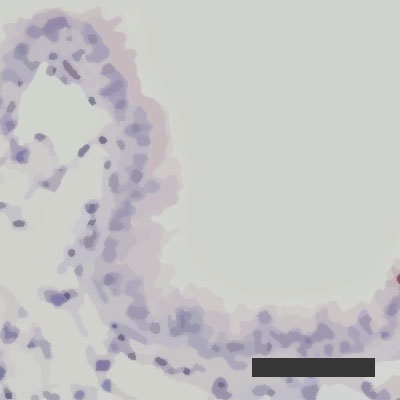 Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 50 %
Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 50 %
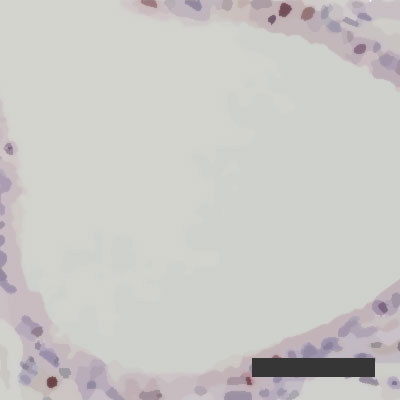 Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 10 %
Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 10 % 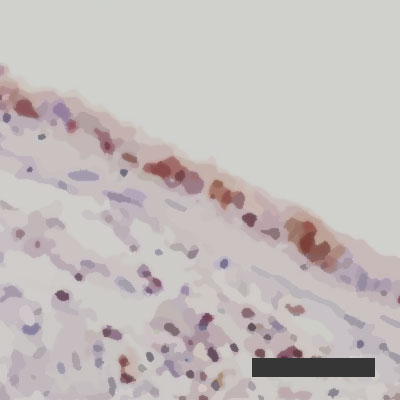 Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 50 %
Regenerační aktivita infikovaných plicních sklípků při vlhkosti vzduchu činící 50 %
Dvě otázky položené dr. Akiko Iwasaki
Jaký vliv má vyrovnaná vlhkost vzduchu v místnostech na osoby vystavené chřipkovému viru?
Jaké ochranné mechanismy poskytuje vyvážené zvlhčování vzduchu?
Již řadu desetiletí je nám známo, že chřipkové vlny se vyskytují hlavně v zimě, kdy je nutno vytápět vnitřní prostory. Přitom se usilovně diskutovalo o důvodech, proč jsou lidé k onemocnění chřipkou náchylní právě v zimním období. Mimo jiná vysvětlení tohoto sezónního výskytu se uvádí vystavování účinkům nízkých teplot, nízká vlhkost vzduchu ve vnitřních prostorech nebo také ve venkovním prostředí, shromažďování osob ve vnitřních prostorech se zvýšenou intenzitou kontaktního nebo kapénkového přenosu a ubývání hladiny vitaminu D ve zdravé krvi z důvodu menší intenzity slunečního záření.
Znalost příčin sezónního výskytu chřipky není zajímavá pouze z teoretického hlediska, protože současně poskytuje povědomí o tom, jaká opatření ke snížení související pravděpodobnosti onemocnění i jeho smrtelných následků lze v praxi přijímat. Téma má mimořádný význam, jelikož rozsah sezónních chřipkových infekcí se nadále zvětšuje a tyto infekce každoročně způsobují nejméně půl milionu smrtelných případů po celém světě. Poskytování vyrovnané vlhkosti vzduchu je ochranné opatření, které podporuje účinky očkování a při jehož realizaci by bylo možné zachránit miliony lidských životů.
V této studii bylo poukázáno na skutečnost, že suchý vnitřní vzduch zesiluje účinky chřipkového onemocnění. Bylo rovněž prokázáno, že regulace relativní vlhkosti vzduchu v rozsahu mezi 40 a 60 procenty přispívá k minimalizaci virových infekcí a ztěžuje proces jejich přenášení. Toto je první studie, která poukazuje na fyziologické mechanismy stojící v pozadí pozitivních výsledků, kterých lze prostřednictvím vyvážené vlhkosti vzduchu dosahovat.
Jaký vliv má vyrovnaná vlhkost vzduchu v místnostech na osoby vystavené chřipkovému viru?
Jaké ochranné mechanismy poskytuje vyvážené zvlhčování vzduchu?
Již řadu desetiletí je nám známo, že chřipkové vlny se vyskytují hlavně v zimě, kdy je nutno vytápět vnitřní prostory. Přitom se usilovně diskutovalo o důvodech, proč jsou lidé k onemocnění chřipkou náchylní právě v zimním období. Mimo jiná vysvětlení tohoto sezónního výskytu se uvádí vystavování účinkům nízkých teplot, nízká vlhkost vzduchu ve vnitřních prostorech nebo také ve venkovním prostředí, shromažďování osob ve vnitřních prostorech se zvýšenou intenzitou kontaktního nebo kapénkového přenosu a ubývání hladiny vitaminu D ve zdravé krvi z důvodu menší intenzity slunečního záření.
Znalost příčin sezónního výskytu chřipky není zajímavá pouze z teoretického hlediska, protože současně poskytuje povědomí o tom, jaká opatření ke snížení související pravděpodobnosti onemocnění i jeho smrtelných následků lze v praxi přijímat. Téma má mimořádný význam, jelikož rozsah sezónních chřipkových infekcí se nadále zvětšuje a tyto infekce každoročně způsobují nejméně půl milionu smrtelných případů po celém světě. Poskytování vyrovnané vlhkosti vzduchu je ochranné opatření, které podporuje účinky očkování a při jehož realizaci by bylo možné zachránit miliony lidských životů.
V této studii bylo poukázáno na skutečnost, že suchý vnitřní vzduch zesiluje účinky chřipkového onemocnění. Bylo rovněž prokázáno, že regulace relativní vlhkosti vzduchu v rozsahu mezi 40 a 60 procenty přispívá k minimalizaci virových infekcí a ztěžuje proces jejich přenášení. Toto je první studie, která poukazuje na fyziologické mechanismy stojící v pozadí pozitivních výsledků, kterých lze prostřednictvím vyvážené vlhkosti vzduchu dosahovat.
Autoři
Název originální publikace: Low ambient humidity impairs barrier function and innate resistance against influenza infection
Odkaz na zdroj: www.pnas.org/content/early/2019/05/07/1902840116
Rok zveřejnění: 13.05.2019
1. Wong GH, Goeddel DV (1986) Tumour necrosis factors alpha and beta inhibit virus replication and synergize with interferons. Nature 323:819–822.
2. Johnson NB, et al.; Centers for Disease Control and Prevention (CDC) (2014) CDC National Health Report: Leading causes of morbidity and mortality and associated behavioral risk and protective factors–United States, 2005-2013. MMWR Suppl 63:3–27.
3. Tamerius JD, et al. (2013) Environmental predictors of seasonal influenza epidemics across temperate and tropical climates. PLoS Pathog 9:e1003194, and erratum 2013 Nov;9(11).
4. Alonso WJ, et al. (2015) A global map of hemispheric influenza vaccine recommendations based on local patterns of viral circulation. Sci Rep 5:1–6.
5. Tamerius J, et al. (2011) Global influenza seasonality: Reconciling patterns across temperate and tropical regions. Environ Health Perspect 119:439–445.
6. Cannell JJ, et al. (2006) Epidemic influenza and vitamin D. Epidemiol Infect 134:1129– 1140.
7. Lowen AC, Steel J (2014) Roles of humidity and temperature in shaping influenza seasonality. J Virol 88:7692–7695.
8. Eccles R (2002) An explanation for the seasonality of acute upper respiratory tract viral infections. Acta Otolaryngol 122:183–191.
9. Shaman J, Pitzer VE, Viboud C, Grenfell BT, Lipsitch M (2010) Absolute humidity and the seasonal onset of influenza in the continental United States. PLoS Biol 8: e1000316.
10. Lowen AC, Mubareka S, Steel J, Palese P (2007) Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathog 3:1470–1476.
11. Iwasaki A, Pillai PS (2014) Innate immunity to influenza virus infection. Nat Rev Immunol 14:315–328.
12. Chen X, et al. (2018) Host immune response to influenza a virus infection. Front Immunol 9:320.
13. Garber EA, Hreniuk DL, Scheidel LM, van der Ploeg LHT (1993) Mutations in murine Mx1: Effects on localization and antiviral activity. Virology 194:715–723.
14. Staeheli P, Grob R, Meier E, Sutcliffe JG, Haller O (1988) Influenza virus-susceptible mice carry Mx genes with a large deletion or a nonsense mutation. Mol Cell Biol 8: 4518–4523.
15. Pillai PS, et al. (2016) Mx1 reveals innate pathways to antiviral resistance and lethal influenza disease. Science 352:463–466.
16. Taubenberger JK, Morens DM (2008) The pathology of influenza virus infections. Annu Rev Pathol 3:499–522.
17. Short KR, et al. (2016) Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J 47:954–966.
18. Bustamante-Marin XM, Ostrowski LE (2017) Cilia and mucociliary clearance. Cold Spring Harb Perspect Biol 9:a028241.
19. Verhelst J, Parthoens E, Schepens B, Fiers W, Saelens X (2012) Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol 86:13445–13455.
20. Everitt AR, et al.; GenISIS Investigators; MOSAIC Investigators (2012) IFITM3 restricts the morbidity and mortality associated with influenza. Nature 484:519–523.
21. Brass AL, et al. (2009) The IFITM proteins mediate cellular resistance to influenza A H1N1 virus, West Nile virus, and dengue virus. Cell 139:1243–1254.
22. Swiecki M, Wang Y, Gilfillan S, Lenschow DJ, Colonna M (2012) Cutting edge: Paradoxical roles of BST2/tetherin in promoting type I IFN response and viral infection. J Immunol 188:2488–2492.
23. Wang X, Hinson ER, Cresswell P (2007) The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts. Cell Host Microbe 2:96–105.
24. Lenschow DJ, et al. (2007) IFN-stimulated gene 15 functions as a critical antiviral molecule against influenza, herpes, and Sindbis viruses. Proc Natl Acad Sci USA 104: 1371–1376.
25. Tang Q, Wang X, Gao G (2017) The short form of the zinc finger antiviral protein inhibits influenza A virus protein expression and is antagonized by the virus-encoded NS1. J Virol 91:e01909-16.
26. Arnheiter H, Skuntz S, Noteborn M, Chang S, Meier E (1990) Transgenic mice with intracellular immunity to influenza virus. Cell 62:51–61.
27. Kolb E, Laine E, Strehler D, Staeheli P (1992) Resistance to influenza virus infection of Mx transgenic mice expressing Mx protein under the control of two constitutive promoters. J Virol 66:1709–1716.
28. Haller O, Staeheli P, Kochs G (2007) Interferon-induced Mx proteins in antiviral host defense. Biochimie 89:812–818.
29. Allen EK, et al. (2017) SNP-mediated disruption of CTCF binding at the IFITM3 promoter is associated with risk of severe influenza in humans. Nat Med 23:975–983.
30. Randolph AG, et al.; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators (2017) Evaluation of IFITM3 rs12252 association with severe pediatric influenza infection. J Infect Dis 216:14–21.
31. Mihaylova VT, et al. (2018) Regional differences in airway epithelial cells reveal tradeoff between defense against oxidative stress and defense against Rhinovirus. Cell Rep 24:3000–3007.e3.
32. Clary-Meinesz CF, Cosson J, Huitorel P, Blaive B (1992) Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biol Cell 76:335–338.
33. Daviskas E, et al. (1995) Changes in mucociliary clearance during and after isocapnic hyperventilation in asthmatic and healthy subjects. Eur Respir J 8:742–751.
34. Oozawa H, et al. (2012) Effect of prehydration on nasal mucociliary clearance in low relative humidity. Auris Nasus Larynx 39:48–52.
35. Moura FE, Perdigão AC, Siqueira MM (2009) Seasonality of influenza in the tropics: A distinct pattern in northeastern Brazil. Am J Trop Med Hyg 81:180–183.
36. Shek LP, Lee BW (2003) Epidemiology and seasonality of respiratory tract virus infections in the tropics. Paediatr Respir Rev 4:105–111.
37. Horisberger MA, Staeheli P, Haller O (1983) Interferon induces a unique protein in mouse cells bearing a gene for resistance to influenza-virus. Proc Natl Acad Sci USA 80:1910–1914.
38. Grimm D, et al. (2007) Replication fitness determines high virulence of influenza A virus in mice carrying functional Mx1 resistance gene. Proc Natl Acad Sci USA 104: 6806–6811.
39. Mastorakos P, et al. (2015) Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy. Proc Natl Acad Sci USA 112:8720–8725.
40. Francis R, Lo C (2013) Ex vivo method for high resolution imaging of cilia motility in rodent airway epithelia. J Vis Exp, e50343.
41. Butler A, Hoffman P, Smibert P, Papalexi E, Satija R (2018) Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nat Biotechnol 36:411–420.
42. Cohen M, et al. (2018) Lung single-cell signaling interaction map reveals basophil role in macrophage imprinting. Cell 175:1031–1044.e18.
43. Steuerman Y, et al. (2018) Dissection of influenza infection In Vivo by single-cell RNA sequencing. Cell Syst 6:679–691.e4.
44. Kudo E, et al. (2019) Low ambient humidity impairs barrier function, innate resistance against influenza infection. NCBI BioProject. Available at https://www.ncbi.nlm.nih.gov/ bioproject/PRJNA528197. Deposited March 20, 2019.
